Ceci est une version archivée de Dapporto2010Francais à 2010-10-30 18:09:04.
Spéciation de Zerynthia polyxena (Lepidoptera, Papilionidae) dans ses refuges méditerranéens et dans son expansion post-glaciaire
Leonardo Dapporto : Istituto Comprensivo Materna Elementare Media Convenevole da Prato, Prato, Italy
Résumé
Les mouvements de populations vers et depuis leur refuges glaciaires sont responsables de nombreux cas de spéciations en Europe. Le type de distribution et le degré de diversification entre les lignées issues des différents refuges glaciaires dépend généralement de l'écologie des populations, en particulier de leur capacité de dispersion. Zerynthia polyxena est une espèce philopatrique, disséminée en petites populations ayant rarement colonisées les zones de montagne. Ces caractéristiques ont été probablement provoquées par des périodes d'isolement répété au cours du Quaternaire qui pourrait avoir favorisé une diversification de l'espèce. Actuellement, deux études basées conjointement sur des données morphologiques et génétiques suggèrent l'existence de deux principales lignées de populations en Europe, ayant pour zone de contact le nord de l'Italie. Dans la présente étude, j'ai observé la morphométrie géométrique des organes génitaux mâles et démontré (i) que deux morpho-types existent en Europe qui se répartissent grosso modo de part et d'autre du Po ; (ii) les deux lignées ont probablement survécu aux glaciations respectivement en Italie et dans les Balkans ; puis la ligné des Balkans s'est étendue vers l'Europe centrale et de l'est ; (iii) aucune population hybridogène ne semble exister dans la zone de contact et, dans une localité au moins, les deux lignées vivant en sympatrie sans individus intermédiaires. Ces résultats suggèrent que (i) deux espèces jumelles de Zerynthia existent en Europe. En conséquence, Papilio cassandra Geyer, 1828 est rétabli, le statut révisé donne Zerynthia cassandra, à laquelle les populations de Zerynthia du sud de l'Italie et du Po correspondent. Les différences de génitalias mâles avec Zerynthia polyxena sont décrits.
Mots clés
Biogéographie - papillons - Europe - spéciation - refuges glaciaires - itinéraires d'expansion - Zerynthia cassandra - Zerynthia polyxena
Introduction
Du fait d'une latitude et d'une topographie particulières, le Sud de l'Europe constitue un cas d'école pour étudier les conséquences des changements climatiques du Quaternaire sur la philogéographie des organismes vivants (Taberlet et al. 1998; Hewitt 1999, 2000, 2004; Schmitt 2007). Pendant les glaciations, le climat de l'Europe Centrale était trop froid et trop aride pour la plupart des espèces de zones tempérées. Un certain nombre de taxons ont survécues aux périodes froides dans les latitudes basses et à des altitudes réduites dans les trois grands territoires du Sud de l'Europe : les péninsules ibérique, italienne et balkanique. Ces territoires ont été isolés les uns des autres durant les extensions glaciaires maximales, du fait de la présence de chaînes de montagnes recouvertes de glaciers infranchissables (Taberlet et al. 1998; Hewitt 1999, 2000). En conséquence, les populations du Sud de l'Europe ont été séparées les unes des autres de façon répétée au cours des différents âges glaciaires. Pendant les périodes de réchauffement, les espèces se sont répandues vers le nord le l'Europe, mais certaines chaînes de montagne sont restées d'importantes frontières géographiques. La phylogéographie comparative montre que chaque taxon représente un cas spécifique liée à son histoire de contraction et d'expansion d'aire (Taberlet et al. 1998), néanmoins certaines tendances sont communes et se rapportent aux paradigmes de colonisation qui ont déjà été décrits (Hewitt 1999, 2000). En particulier, l'écart génétique généralement élevé entre les lignées italiennes et celles du reste de l'Europe suggère que les Alpes représentent le principal obstacle à l'expansion post-glaciaire vers le nord (Taberlet et al. 1998). En conséquence, l'Italie a conservé une lignée endémique qui a évolué par isolement et à l'arrière de la chaîne des Alpes (Taberlet et al. 1998). Dans une moindre mesure, les Pyrénées ont également été un obstacle à la propagation post-glaciaire de plusieurs populations ibériques (Hewitt 1999, 2000). Par contraste, les lignées des Balkans ne rencontrèrent pas d'obstacles majeur limitant leur expansion et leur génomes sont prédominants dans la plupart des populations d'Europe Centrale (Taberlet et al. 1998; Hewitt 1999, 2000, 2004; Schmitt 2007).
Chez plusieurs espèces de papillons, les périodes d'isolement glaciaires et postglaciaires génèrent une diversification des lignées propres à chaque zone refuge (Schmitt 2007). Malgré cela, dans la plupart des cas, la diversification ne produit pas des taxons différenciés au niveau spécifique (Porter et al. 1997; Schmitt et al. 2005). Cela est probablement du à la relative brièveté des périodes d'isolement et à la grande capacité de dispersion des papillons. En fait, quand des lignées différentes de papillons se rejoignent au cours de leur expansion, ils ont formé des zones d'hybridation (Schmitt, 2007). En Europe, les zones d'hybridation sont concentrées dans des zones de suture qui se situent pour la plupart entre les Alpes et les Pyrénées.
Les possibilités différentes d'expansion selon le type d'obstacle géographiques rencontré sont globalement à l'origine des distributions actuelles (Taberlet et al. 1998). La capacité de dispersion n'est pas la même selon les espèces. La divergence entre différentes lignées devrait être plus élevé chez les taxons montrant une faible mobilité, des exigences écologiques plus fortes besoins en habitat stricte et une inaptitude à vivre à des altitudes élevées (Schmitt et al. 2003; Dapporto and Dennis 2009). En effet, dans ce cas de figure, les flux de gènes au delà de chaînes de montagnes sont considérablement réduits au cours des périodes de glaciation et il pourrait en être de même pendant les périodes plus chaudes. La Diane Zerynthia polyxena (Denis and Schiffermüller, 1775) offre une opportunité d'étudier les conséquences de longues périodes d'isolement sur les lignées de papillons. En effet, cette espèce est strictement liée à des micro-habitats où la plante-hôte des chenilles (Aristolochia spp.) se développe et il est très rare d'observer des individus loin de ces stations (Verity 1947). De plus, il est bien connu de Z. polyxena est une espèce thermophile rarement observée au delà de 900 mètres d'altitude (Higgins and Riley 1983; Tolman and Lewington 1997). Enfin, ce papillon est monovoltin et sa période de vol se limité à quelques semaines. Tous ces éléments suggèrent que Z. polyxena pourrait avoir connu de longues périodes d'isolement dans ses refuges glaciaires au cours du Quaternaire. Curieusement, deux documents suggèrent de manière indépendante l'existence de deux lignées hautement différenciées de Zerynthia en Europe. Coutsis (1989) a décrit des différences de génitalias mâles entre les spécimens provenant de Sicile et de Florence (Toscane) et les spécimens provenant de France, d'Italie du Nord et des Balkans. Par la suite, Nazari et Sperling (2007) ont souligné profondes divergences génétiques entre les deux populations de la Sicile et Imola (à environ 75 km de Florence) et certaines populations de Russie, d'Ukraine et les dalkans (Kosovo, Monténégro, Serbie et Grèce). Ils ont conclu que cette forte divergence pourrait correspondre à une possible spéciation, mais ils se sont abstenus de faire des conclusions taxonomiques en raison de l'absence d'investigations morphologiques suffisantes. Dans une autre voie, Coutsis (1989) a soutenu que deux morphotypes étaient présents en Italie. Il indiquait en conclusion qu'une étude de la possibilité de chevauchement géographique des deux formes et de l'existence de populations hybrides serait souhaitable. Dans la présente étude, la morphologie des génitalia mâles d'un large échantillon de Z. polyxena européens a été examiné, en supposant que la zone de contact se situait entre l'Italie, la France et les Balkans.
L'approche de géométrie morphométrique est basée sur l'utilisation de repères et de repères semi-coulissants (Bookstein 1997). Cette méthode est un outil puissant permettant d'obtenir des données numériques sur la forme des organes génitaux, ce qui permet de limiter les biais ou les relevé subjectifs, tels que la taille globale des échantillons étudiés (Mutanen 2005; Mutanen et Pretorius 2007; Dapporto 2008; Dapporto et Strumia 2008). L'objectif de cette étude est de vérifier (i) si deux lignées morphologiquement distinctes de Zerynthia existent en Europe, (ii) quelle est l'origine de leur répartition sur la base des modèles de paradigmes des refuges glaciaires et d'expansion d'aire post-glaciaire, (iii) quel la nature de leur zone de contact (par exemple : forment-elles des populations hybrides), et (iv) si les deux morphotypes concordentsavec l'hypothèse de Coutsis (1989) et de Nazari et Sperling (2007) qui pensent que deux espèces sœurs de Zerynthia existent en Italie.
Matériel et méthodes
L'espèce étudiée
La Diane Z. polyxena est un papillon de la famille des Papilionidés du sud de la France, d'Italie, d'Europe Centrale et des Balkans, de la Russie et de l'Asie Mineure.
Les adultes sont très colorés de blanc / jaune, avec de nombreuses taches noires, rouges et bleues. En raison de la très grande variabilité des motifs sur les ailes, des dizaines de sous-espèce et de formes, même appartenant aux mêmes populations, ont été décrites. Zerynthia polyxena ne se nourrit que sur quelques espèces d'aristoloches. Comme ces plantes sont généralement limitées à quelques régions, le papillon est habituellement réparti en petites populations vulnérables. Pour cette raison, la Diane est une espèce d'intérêt communautaire inscrit dans l'annexe IV de la Directive 92/43 CEE, dite Directive "Habitat". La période de vol est extrêmement courte, allant de la mi-Mars à la mi-mai selon l'altitude et la latitude (Verity 1947; Higgins et Riley, 1983; Tolman et Lewington 1997).
Echantillon étudié et préparation des génitalias
Un total de 186 mâles appartenant à des collections privées ou de Muséums ont été examinés (celle des auteurs, de la collection privée de Gabriele Fiumi private, de la collection Roger Verity au Museo di Storia Naturale Universita di Firenze ; la collection Prola du Museo Civico di Storia Naturale di Roma; la collection du Staatliche Naturwissenschaftliche Sammlungen Bayerns). La zone d'étude a été divisée selon sept régions : (i) Sud de la France (Nîmes n = 9; Ardèche n = 1; Toulon n = 8; Saint-Crépin n = 4 ; Villeneuve-Loubet n = 5); (ii) Nord de l'Italie (comme défini par Balletto et Cassulo 1995) (Torino n = 13; Salbertrand n = 10; Vigevano n = 6; Vercelli n = 10; Reggio Emilia n = 3; Modena n = 6; Bologna n = 3; Ventimiglia n = 1; Monte Beigua n = 11; Rapallo n = 1; La Spezia n = 8; Forli n = 1; Ravenna n = 2; Belluno n = 3; Trieste n = 1; Udine n = 1); (iii) Sud de l'Italie (Forte dei Marmi n = 4; Pisa n = 5; Pontremoli n = 4; Livorno n = 3; Prato n = 9; Firenze n = 4; Pari n = 1; Roma n = 1; Fano n = 1; Monticchio n = 2; Foggia n = 1); (iv) L'île d'Elbe, n = 5; (v) Sicile (Castelbuono n = 1; Etna env. n = 7); (vi) Balkans (Bosnie Herzégovine, Brod n = 1; Croatie, Dalmatie n = 1, Zara n = 2, Pula n = 2; Potravlje n = 2, Zagreb n = 3; Macédoine, Skopje n = 2); et (vii) Europe Centrale et de l'Est (Tchéquie Lednice n = 3, Harrachov n = 1, Slovaquie n = 1; Autriche, Wien n = 2, Gumpoldskirchen n = 1, Kitzeck n = 2, Burgenland n = 1; Hongrie, Budapest n = 3; Ukraine, Kharkov n = 4) (Fig. 1). La
La séparation des sept zones géographiques peut paraître subjective, mais cela a uniquement servi à dessiner les cartes et à réaliser les graphiques, sans qu'aucune analyse ou classification a priori n'ait été réalisée. Les génitalias ont été disséqués en utilisant la procédure standard (Dapporto 2008). Les abdomens ont été porté à ébullition dans de l'hydroxyde de potassium (potasse) à 10%. Les génitalias ont été nettoyés et les valves gauche a été montées sous Euparal entre une lames de microscope et une lamelles. Ils ont été photographiés à l'aide d'un appareil photo Nikon Coolpix 4500 (Nikon, Tokyo, Japon) en digiscopie sur une loupe binoculaire.
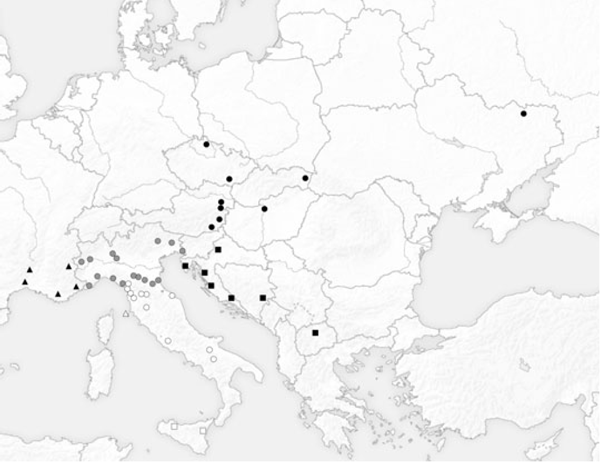
Fig. 1. Carte de la zone d'étude : échantillons de France (triangles noirs); d'Europe Centrale et de l'Est (cercles noirs); Balkans (carrés noirs); Nord de l'Italie (cercles gris); Sud de l'Italie (cercles blancs); Ile d'Elbe (triangles blancs); Sicile (carrés blancs).

Fig. 2. Représentation schématique des repères fixes (cercles blancs) et des repères semi-coulissants (cercles noirs) utilisés pour les analyses de géométrie morphométrique.
Geometric morphometrics and statistical analyses
Une combinaison de repères fixes et de repères semi-coulissants a été appliquée pour les relevés de géométrie morphométrique (Bookstein 1997). Cette méthodologie autorise des exploitations quantitatives et des comparaisons de forme. Les séries de programmes Thin-Plate-Spline (TPS) ont été utilisés pour ces analyses (Rohlf 2006a, b, 2007). Les sections latérales de la valve ont été examinées (Fig. 2). Cinq points sur les grandes lignes qui pouvaient être précisément identifiés ont été considérés comme repères (repères de type II et III, Bookstein 1997), tandis que les autres points (repères semi-coulissants) ont été autorisés à bouger, de façon à réduire les variations non informatives (Bookstein 1997) (Fig. 2). Les relevés numériques par repère sur les photographies des génitalias ont été réalisées avec tpsdig 2.10 (Rohlf 2006a) et la définition des échelles à l'aide de tpsutil 1.38 (Rohlf 2006b).
Des analyses généralisées ont été appliquées aux données des points de repère pour éliminer les variations non-conformes de localisation, d'échelle et d'orientation et pour pouvoir superposer les relevés dans un même système de coordonnées (Bookstein 1997). En utilisant les formes résiduelles pour les analyses généralisées, les déformations partielles ont été calculées sous forme de variables contenant des informations sur la forme. En appliquant des analyses des principales composantes sur les déformations partielles observées, des déformations relatives ont été obtenues (RW). RW ont été utilisées comme variables dans les analyses suivantes. En outre, les RW peuvent être visualisés par des grilles de déformation à partir des Thin-Plate Spline (TPS), qui permettent une comparaison visuelle des différences de forme. Les analyses généralisées, partielles et relatives, la visualisation sur TPS ont été conduites avec tpsrelw 1.45 (Rohlf 2007). Pour vérifier si similarité de forme mis en évidence par la morphométrie géométrique a une signification statistique, j'ai appliqué un algorithme de K-moyenne aux valeurs RW. Selon Nazari et Sperling (2007) et Coutsis (1989), deux lignées semblent exister ; pour cette raison, la formation de deux groupes a été imposée. Pour réduire le biais dû à un nombre élevé de variables peu informatives, seule les RW correspondant à plus de 1% de variance ont été inclus dans K-moyenne (Dapporto 2008; Dapporto et Strumia 2008).
Résultats
Après les analyses généralisées, 66 RW ont été calculés. Les RW exprimant plus de 1% de la variance ont été de 11 (expliquant un écart cumulé de 93,19%). Un nuage de points de RW1 et RW2 (expliquant respectivement 37,01 et 19,63% des
variances) a révélé la présence de deux groupes distincts de forme des valves (Fig. 3). Comme le montre les grilles de déformation TPS, les valves reflètent à la fois une extension et une contraction de l'extrémité distale des valves correspondant à la moitié des échantillons (en haut à gauche de la Fig. 3). En outre, RW1 reflète aussi les différences dans la longueur de la valve ventrale, tandis que RW2 reflète un effet de rotation à la pointe de la valve. La variation de la forme à travers TPS est très concordant avec la description de Coutsis (1989). En maximisant et minimisant respectivement les inter-groupes et les différences intra-groupes , K-Moyenne a identifié deux groupes. RW1, RW2 et RW8 s'avèrent être significativement différents entre les deux groupes, ce qui représente les variables responsables de la discrimination (tableau 1).
En comparaison avec le diagramme de dispersion de la Fig. 3, K-Moyenne a confirmé la validité des deux groupes. En effet, tous les échantillons situés dans le côté gauche de la ligne pointillée sont classés dans le groupe 1, tandis que tous les spécimens placés à droite de la ligne pointillé appartiennent au groupe 2 (Fig. 3). Le groupe 1 regroupe tous les spécimens du sud de l'Italie, de la Sicile, de l'île d'Elbe et de plusieurs populations de l'Italie du Nord. En particulier, tous les spécimens de Reggio Emilia, Modène, Bologne, Vintimille, Rapallo, La Spezia, Forli, Ravenne et neuf spécimens de Monte Beigua sont inclus dans le groupe 1. Le groupe 2 rassemble les spécimens provenant de France, des Balkans, d'Europe centrale et de l'Est, tous les échantillons provenant des populations du nord de l'Italie : Turin, Salbertrand, Vigevano, Vercelli, Belluno, Trieste, Udine et trois échantillons du Monte Beigua (Fig. 4). Il est de plus évident que chaque population accueille une seule des deux lignées, à l'exception du Monte Beigua où les deux morphes ont été trouvées (Fig. 4). Toutefois, même dans cette population, la présence d'individus intermédiaires n'a pas été mise en évidences. De plus, les différences morphologiques entre les spécimens appartenant à chaque lignée conservent une certaine homogénéité (Fig. 3). La distribution des deux lignées montre une nette séparation dans le nord de l'Italie, c'est le Po qui représente approximativement la ligne de démarcation (Fig. 4).
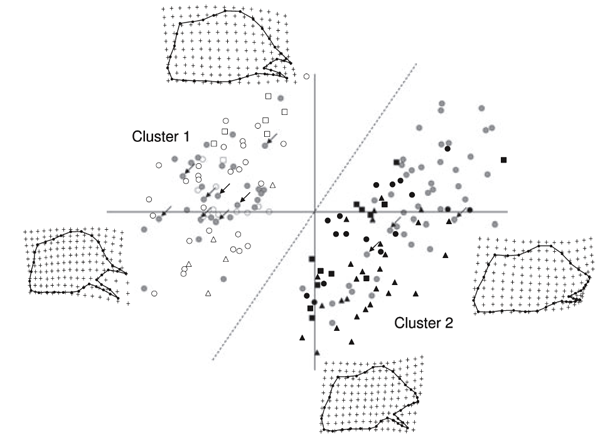
Fig. 3. Représentation graphique de la première (en abscisse) et de la seconde (axe des y) forme relative (RW) des valves. Les variations dans la forme le long des deux axes sont présentées dans des grilles de déformation Thin-Plate-Spline (TPS). La ligne pointillée indique la séparation des échantillons du groupe 1 et du groupe 2 obtenu par K-Moyenne. Les flèches indiquent les échantillons de Monte Beigua. Les symboles sont les mêmes que ceux utilisés dans la figure. 1
Tableau 1. Anova table pour K-Moyenne
| Shape bariable | Anova F | p-values |
| RW1 | 575.584 | 0.000 |
| RW2 | 22.628 | 0.000 |
| RW3 | 0.210 | 0.647 |
| RW4 | 1.686 | 0.196 |
| RW5 | 0.622 | 0.431 |
| RW6 | 0.612 | 0.435 |
| RW7 | 0.088 | 0.767 |
| RW8 | 7.110 | 0.008 |
| RW9 | 1.386 | 0.241 |
| RW10 | 0.117 | 0.733 |
| RW11 | 0.099 | 0.753 |
Les variables en gras montrent les différences significatives entre les deux groupes.
Discussion
Zerynthia polxena présente deux morphotypes clairement distincts en Europe. En effet, les échantillons peuvent être séparés en deux groupes selon la forme des génitalias. L'utilisation de la morphométrie géométrique et de K-Moyenne évite l'utilisation de toute forme d'évaluation subjective et de classifications de spécimens a priori. Les déformations relative montrent que la plus haute valeur significative de K-Moyenne explique aussi une plus grande variance forme, ce qui implique que la plupart des variations de génitalias induit aussi la différenciation des deux lignées. La séparation des échantillons en deux groupes nous éclaire sur la répartition géographique évidente. En effet, tous les spécimens de la Sicile, de l'île d'Elbe et l'Italie du Sud appartiennent au premier groupe, alors que tous les échantillons provenant des Balkans, de France et d'Europe Centrale et de l'Est appartiennent au second groupe. Tous les échantillons italiens collectés au Nord du Po ont été attribués au deuxième groupe, tandis que les spécimens appartenant à des zones situées au Sud du Po correspondent au premier groupe, à l'exception de trois échantillons du Monte Beigua (Fig. 3). La répartition européenne postglaciaire de Zerynthia polyxena (Fig. 5) ressemble fortement au paradigme dit "du criquet" (Hewitt 2000, 2004). Chorthippus parallelus (Zetterstedt, 1821), le Criquet des pâtures, est représenté dans le sud de l'Europe par plusieurs lignées distinctes, tandis qu'en Europe Centrale et en Europe du Nord, ses haplotypes montrent une faible diversité et sont similaires à ceux des Balkans (Hewitt 2000). Le paradigme du criquet peut être appliqué aux espèces présentant des difficultés à franchir les barrières montagneuses formées par les Alpes et les Pyrénées. En effet, en provenance des Balkans, et non entravé par des chaînes de montagne escarpées, il leur est facile de s'étendre à l'Europe centrale ; les populations d'Italie et la Péninsule Ibérique en revanche ont souvent été limitées au nord par les Alpes et les Pyrénées. La principale différence entre le mode de répartition de C. parallelus et Z. polyxena semble être l'absence d'une lignée ibérique de Zerynthia. Les C. parallelus ibériques sont, cependant, fortement différenciées des autres lignées montrant que l'hybridation a été limitée dans les Pyrénées, ils représentent donc peut-être une espèce jumelle (Butlin et Hewitt, 1985). Curieusement, le genre Zerynthia est représenté dans la péninsule ibérique et au Maghreb par l'espèce proche Zerynthia rumina (Linnaeus, 1758), qui occupe exactement dans la même niche écologique que les autres Zerynthia de l'Est. Par conséquent, le genre Zerynthia semble présenter de nombreuses similitudes avec les complexes d'espèces Melanargia galathea (Linnaeus, 1758) / Melanargia lachesis (Hübner, 1790) et Polyommatus coridon (Poda, 1761) / Polyommatus hispana (Herrich-Schäffer, 1852) (Schmitt, 2007). Une autre différence entre la distribution de C. parallelus et de Z. polyxena apparaît. Le sud de la lignée italienne n'atteint pas le versant sud des Alpes (à l'exception de la population méditerranéenne de Ventimiglia).
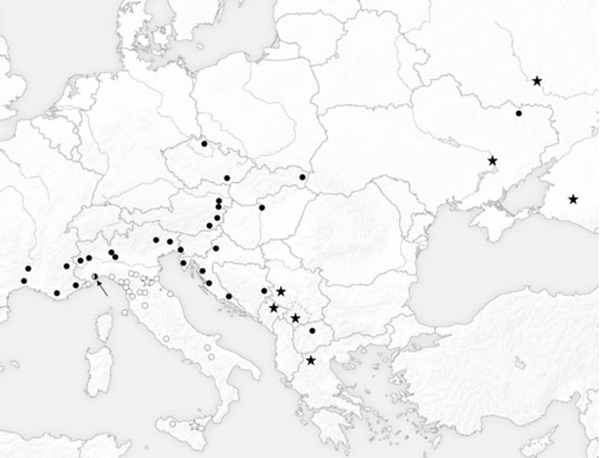
Fig. 4. K-Means attribution of specimens to the two lineages. Only the Monte Beigua sample (indicated by the arrow) shoes a mixed population. White circles, Southern Italian lineage, black circles Balkan lineage. White and black stars represent populations attributed to two different genetic lineages by Nazari and Sperling (2007)
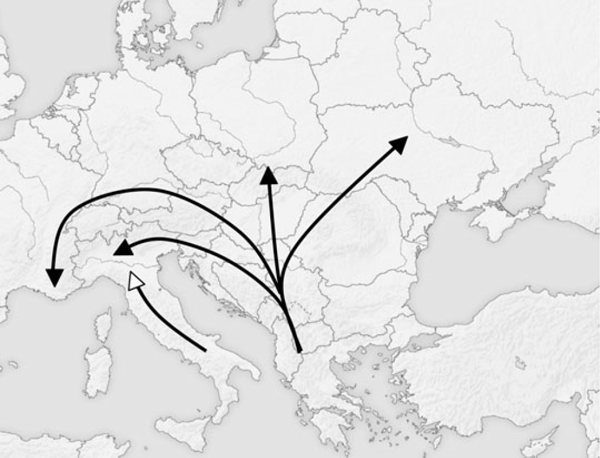
Fig. 5. Supposed post-glacial colonization routes for the two Zerynthia lineages
Il n'existe pas de barrière apparente séparant les deux morphotypes tandis qu'ils se rencontrent sur les deux rives du Po. Malgré la faible mobilité de Z. polyxena, le Po ne peut pourtant pas représenter un obstacle à sa distribution, car la Diane vole généralement dans les basses terres marécageuses de l'Italie (Verity, 1947). Ainsi, la tendance observée est probablement le résultat d'une forte expansion de la lignée des Balkans à l'Europe centrale, ainsi que la France et l'Italie du Nord, et une expansion limitée de la lignée italienne en remontant le long de la péninsule italienne. Très probablement, au cours de la dernière glaciation maximale, la lignée italienne de Z. polyxena a été cantonnée à l'extrême sud de la péninsule italienne et la Sicile. Dans le Nord de l'Italie où les deux lignées se rencontrent, il n'existe aucune preuve de l'existence d'individus intermédiaires. En effet, Fig. La figure 3 montre que dans le Nord de l'Italie, les spécimens appartenant aux deux lignées différentes qui sont complètement séparés et les différences de forme sont équivalentes aux spécimens en provenance des autres régions. Enfin, sur le Monte Beigua, les deux lignées volent en sympatrie sans aucune preuve d'individus intermédiaires (fig. 3, 4 et 7). Entre les populations échantillonnées des deux espèces dans le Nord de l'Italie (Fig. 4), il pourrait exister d'autres populations présentant simultanément les deux lignées.
Mallet (2005) a constaté qu'environ 12% des espèces de papillons européens peuvent s'hybrider, et effectivement, l'hybridation dans les zones de suture post-glaciaire se produit dans des espèces jumelles reconnues pour être de bonnes espèces (par exemple Melanargia galathea / Melanargia lachesis échiquier, Habel et al. 2005). L'hybridation est finalement la règle entre les lignées diversifiées à des rangs de sous-espèces ou de quasi-espèces. Par exemple, Pontia daplidice (Linnaeus, 1758) / daplidice edusa (Fabricius, 1777), et différentes lignées de Maniola jurtina (Linnaeus, 1758) et d'Erebia medusa (Denis et Schiffermüller, 1775) montrent que les zones d'hybridation peuvent être identifiées par des aspects morphologiques et génétiques transitoires (Porter et al 1997; Schmitt et al 2005; Schmitt et Müller 2007; Dapporto et al, sous presse.). Cela ne semble pas être le cas des Zerynthia en Italie où les populations situées à seulement quelques dizaines de kilomètres les unes des autres montrent une morphologie des génitalias complètement différente. La configuration des Thin-Plate-Spline de RW1 et RW2 a révélé que les différences de forme des valves entre les deux morphotypes sont très concordants avec la description de Coutsis (1989), soutenant ainsi son hypothèse de la présence de deux espèces de Zerynthia en Italie. Nazari et Sperling (2007) ont également supposé l'existence de deux Zerynthia distincts sur la base d'analyses génétiques.
Ils ont observé une divergence de 2,4% des séquences entre l'ADN mitochondrial de deux populations italiennes par rapport à ceux des Balkans et d'Europe de l'Est. Malgré l'utilisation de pourcentages de divergence des séquences dans des limites dont il été prouvé qu'elle n'était pas adéquates (Rubinoff et Holland 2005; Cognato 2006), une divergence de 2% et moins est commun chez des espèces jumelles de lépidoptères bien caractéristiques (Avise 1994; Hebert et al 2003;. Nazari et Sperling, 2007). Nazari et Sperling ont aussi calculé le taux de divergence des séquences d'ADN mitochondrial dnas le genre Zerynthia qui se situe entre 2,3% et 3,1% par million d'années. En conséquence, les deux lignées sont issues d'un ancêtre commun qui date de de 1.0 à 0.8 millions d'années, ce qui correspond approximativement au début de la période glaciaire du de Günz, soit au Pléistocène inférieur (environ 0,7 millions d'années). Il est inévitable d'associer la diversification forte et ancienne de Z. polyxena à ses caractéristiques écologiques. En effet, le degré de diversification des lignées est généralement étroitement lié à leurs capacités de dispersion et de colonisation (Taberlet et al. 1998). Schmitt et al. (2003) ont démontré que les populations européennes de Polyommatus icarus (Rottemburg, 1775) ne montrent pas une répartition régionale en unités génétiquement différenciées. Les auteurs ont suggéré que P. icarus a maintenu une structure métapopulationnelle intacte dans la région méditerranéenne, sans générer de forte diversification. En fait, P. icarus est un papillon mobile, formant des populations denses et continues capables de coloniser la plupart des paysages du niveau de la mer jusqu'à 2900m d'altitude. En outre, ce papillon vole pendant environ 7-9 mois en plusieurs générations et la larve se développe sur de nombreuses plantes (Tolman et Lewington 1997; Schmitt et al 2003.). Zerynthia polyxena représente un cas inverse car c'est un papillon sédentaire montrant une courte période de vol, formant de petites populations dispersées et inféodées à une famille botanique, sans compter qu'il est rare en montagne. Les espèces possédant des capacités de dispersions présentent habituellement plusieurs lignées en Europe avec des zones d'hybridation (Schmitt, 2007). De futures études comparatives permettront de révéler de possibles corrélations entre leur écologie et leur tendance à former et maintenir des lignées distinctes en Europe. En conclusion, il existe des preuves génétiques et morphométriques qu'il n'y a pas existé de flux de gènes entre les deux lignées de Zerynthia depuis 0.9 millions d'années (y compris depuis plusieurs périodes interglaciaires). Les hypothèses les plus probables qui expliquent cette situation sont : (i) que les papillons n'ont été de nouveau en contact que très récemment; (ii) ils se sont déjà rencontrés par le passé, mais ils avaient déjà développé des barrières empêchant l'hybridation et l'échange de gènes, (iii) ils ont pu se rencontrer et s'hybrider, mais les populations hybridogènes se sont éteintes par la suite.

Fig. 6. Males of Zerynthia cassandra (a–f) and Zerynthia polyxena (g–o). (a) neotype, Prato; (b) Etna, Sicily; (c,d) Monticchio; (e,f) Monte Beigua; (g) Potravlje; (h) Monte Beigua; (i) Villeneuve de Loubet; (j) Wien; (k) Vercelli; (l) Salbertrand; (m) Belluno; (n) Pula; (o) Lednice
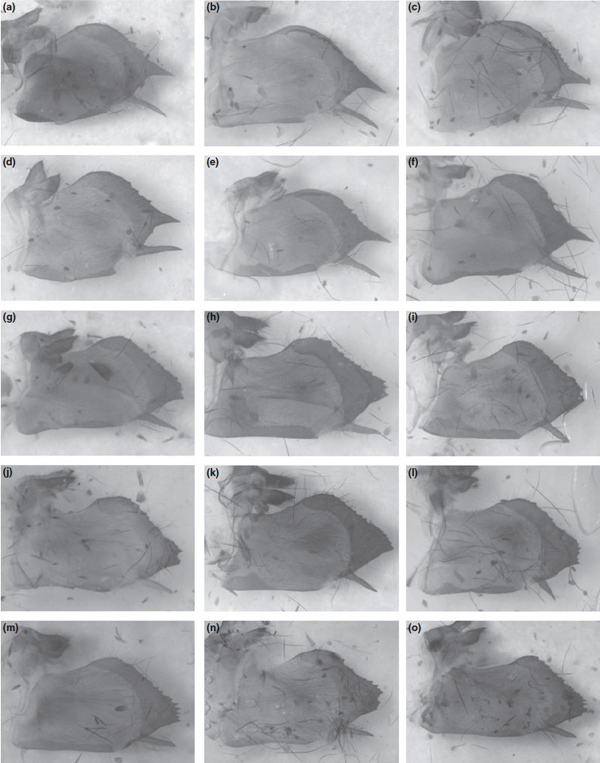
Fig. 7. Male genitalia of Zerynthia cassandra. (a–f) and Zerynthia polyxena (g–o). (a) neotype, Prato; (b) Etna, Sicily; (c,d) Monticchio; (e,f) Monte Beigua; (g) Potravlje; (h) Monte Beigua; (i) Villeneuve de Loubet; (j) Wien; (k) Vercelli; (l) Salbertrand; (m) Belluno; (n) Pula; (o) Lednice
La forte divergence morphologique et génétique, l'absence de populations intermédiaires et l'existence d'au moins un domaine où les deux lignées volent en sympatrie, soutiennent l'hypothèse que deux espèces jumelles de Zerynthia vivent en Europe, et il est donc nécessaire de réviser la taxonomie des deux taxons.
Zerynthia cassandra (Geyer, 1828)
La localité type de Z. polyxena est Vienne où la lignée des Balkans vole (fig. 3, 4 et 7). De nombreuses études ont été menées décrivant plusieurs taxons Zerynthia en Italie sur la base de la morphologie alaire. Papilio cassandra Geyer, 1828, et Thais creusa Meigen, 1829 sont les plus anciens.Ces entités ont été décrites comme distincte de Z. polyxena par l'absence d'une tache rouge sur l'aile antérieure sommet et la présence de grandes zones noires sur les deux ailes (Hemming 1934, 1937; Higgins et Riley, 1983; Tolman et Lewington 1997). Il est à noter que pour cette sous-espèce ont également été référencées les populations francçaises (Higgins et Riley, 1983; Tolman et Lewington 1997) appartenant à la lignée des Balkans. Hemming (1934) a révisé la position systématique de ces entités et a indiqué que ce taxon devait être considérés comme une sous-espèce distincte de Z. polyxena, et restreint la localité type des deux sous-espèces en concluant que Papilio cassandra et Thais creusa étaient tous les deux fondés sur des spécimens provenant de Toscane (Hemming 1934, 1937).
Dans un premier article, Hemming (1934) a également conclu que T. creusa, décrit en 1829 par Geyer devrait être considéré comme le nom le plus ancien car antérieur à la description de P. cassandra datée de 1827 à 1830. Successivement, cette hypothèse a été révisée par Hemming lui-même parce que de nouveaux éléments appartenant à une liste de vente de Geyer daté d'avril 1828 a prouvé que P. cassandra avait été décrite entre juillet 1827 et avril 1828 (Hemming, 1937). Ainsi, P. cassandra doit être considéré comme le plus âgé des deux noms.
Par conséquent, les populations de la péninsule italienne, de l'île d'Elbe et de la Sicile sont ici considérés comme représentantes d'une espèce distincte et endémique d'Italie qui doit être désignée comme Zerynthia cassandra (Geyer, 1828). Les motifs des ailes ne sont pas assez discriminants parce que, comme le montre la figure. 6, les différences intra-spécifiques sont souvent plus grandes que les différences inter-spécifiques. Inversement, chez Z.cassandra, les organes génitaux ont à l'extrémité distale du valve, une proéminence cylindrique pointue, qui est toujours absente chez Z. polyxena. La marge distale est également moins dentée et la partie ventrale de la valve (Harpe) est généralement plus longue et plus rectiligne que chez Z. polyxena (Fig. 7). Pour finir, l'Aedeagus est fine et droite, avec des élargissements nets à la base.
A ce jour, j'ai été en mesure d'établir que le spécimen type ou une série de P. cassandra sont perdus, il n'existe aucune preuve de l'existence de la collection de papillons de Carl Geyer dans les travaux de référence (Hagen 1862; Horn et Schenkling 1928-1929, Horn et Kahle 1935-1937, Horn et al. 1990). Les spécimens représentés par Geyer (1828) ont probablement été inclus dans la collection de Jacob Hübner, qui fut détruite par un incendie à Vienne en 1848. En outre, bien que je n'ai trouvé en Toscane que des spécimens correspondant à Z. cassandra, l'existence de localités toscanes habitées à la fois par Z. cassandra et Z. polyxena ne peut pas être exclu. Afin d'assurer la définition objective et sans équivoque de l'identité de Z. cassandra, il est nécessaire de désigner un néotype, après l'article 75 du Code de nomenclature. Le néotype est un mâle étiqueté comme suit : Italie : Prato : San Giorgio a Colonia : 20.V.2009, Leonardo Dapporto leg., déposé au Museo di Storia Naturale dell Universita di Firenze La Specola, section Entomologia (Figs. 6a et 7a).
Remerciements
Je remercie Luca Bartolozzi (Museo di Storia Naturale Universita di Firenze) pour avoir autorisé l'examen de la collection Roger Verity ; Eric Bonora (Torino), Franco Crespi (Modena), Gabriele Fiumi (Forli), Axel Hausmann (Staatliche Naturwissenschaftliche Sammlungen Bayerns), Marco Pizzetti (Parme), Enrico Giuseppe et Punta Vignali (Massa) pour la collection et le prêt de spécimens. Otakar Kudrna (Naturmuseum Südtirol, Bozen), Alessandro Minelli (Département de biologie, Université de Padoue), Thomas Schmitt (Department of Biodiversity, l'Université de Trier), Alberto Zilli (Museo Civico di Zoologia di Roma), et un lecteur anonyme pour leurs suggestions qui ont grandement amélioré une première version du manuscrit. Cette étude a été menée en collaboration avec le Parc national de l'Archipel toscan et partiellement financé par l'ENEL et Legambiente projet Insieme per la Biodiversita : un santuario per le farfalle nel Parco Nazionale dell Arcipelago Toscano.
References
Avise JC (1994) Molecular Markers, Natural History and Evolution. Chapman and Hall, New York.
Balletto E, Cassulo LA (1995) Lepidoptera Hesperioidea, Papilionidea. In: Minelli A, Ruffo S, La Posta S (eds), Checklist Delle Specie Della Fauna Italiana 89. Calderini, Bologna, pp 1–11.
Bookstein FL (1997) Landmark methods for forms without landmarks:
localizing group differences in outline shape. Med Image
Anal 1:225–243.
Butlin RK, Hewitt GM (1985) A hybrid zone between Chorthippus
parallelus parallelus and Chorthippus parallelus erythropus (Orthoptera:
Acrididae): behavioural characters. Biol J Linn Soc 26:287–
299.
Cognato AI (2006) Standard percent DNA sequence divergence for
insects does not predict species boundaries. J Econ Entomol
99:1037–1045.
Coutsis JG (1989) Valval variation in Zerynthia polyxena (Denis and Schiffermu¨ ller) (Lepidoptera; Papilionidae). Ent Gaz 40:281–282.
Dapporto L (2008) Geometric morphometrics reveal male genitalia differences in the Lasiommata megera⁄paramegaera complex (Lepidoptera, Nymphalidae) and the lack of a predicted hybridization area in the Tuscan Archipelago. J Zool Syst Evol Res 46 : 224-230.
Dapporto L, Dennis RLH (2009) Conservation biogeography of large Mediterranean islands. Butterfly impoverishment, conservation priorities and inferences for an ecological island paradigm. Ecography 32 : 169–179.
Dapporto L, Strumia F (2008) The thorny subject of insular endemic taxonomy: morphometrics reveal no evidence of speciation between Coenonympha corinna and Coenonympha elbana butterflies (Lepidoptera: Nymphalidae). Zootaxa 1755 : 47–56.
Dapporto L, Bruschini C, Baracchi D, Cini A, Gayubo SF, Gonzalez JA, Dennis RLH. Phylogeography and counter-intuitive inferences in island biogeography: evidence from morphometric markers in the mobile butterfly Maniola jurtina (Linnaeus) (Lepidoptera, Nymphalidae). Biol J Linn Soc, in press.
Hagen HA (1862) Bibliotheca Entomologica. Die Literatur U¨ ber das Ganze Gebiet der Entomologie bis zum Jahre 1862. 1. Band A-M. Wilhelm Engelmann, Leipzig.
Hebert PND, Ratnasingham S, deWaard JR (2003) Barcoding animal life: cytochrome c oxidase subunit 1 divergences among closely related species. Proc R Soc Lond B 270 (Suppl.): S96–S99.
Hemming AF (1934) Revisional notes on certain species of Rhopalocera (Lepidoptera). Stylops 3:193–200.
Hemming AF (1937) Hu¨ bner, a Bibliographical and Systematic Account of the Entomological Works of Jacob Hu¨ bner and of the
Supplements Thereto by Carl Geyer, Gottfried Franz von Frölich and Gottlieb August Wilhelm Herrich-Scha¨ ffer, Vols 1& 2. Royal
Entomological Society of London, London.
Hewitt GM (1999) Post-glacial re-colonization of European biota. Biol J Linn Soc 68:87–112.
Hewitt GM (2000) The genetic legacy of the Quaternary ice ages. Nature 405:907–913.
Hewitt GM (2004) Genetic consequences of climatic oscillations in the Quaternary. Phil Trans R Soc Lond B 359:183–195.
Higgins LG, Riley ND (1983) A Field Guide to the Butterflies of Britain and Europe. Collins, London.
Horn W, Kahle I (1935-1937) U¨ ber Entomologische Sammlungen, Entomologen und Entomo-Museologie. Entomologische Beihefte. Deutsches Entomologisches Institut, Berlin.
Horn W, Schenkling S (1928-1929) Index Literaturae Entomologicae. Die Weltliteratur u¨ ber die gesamte Entomologie bis inclusive 1863, 4 Ba¨ nde. Berlin-Dahlem.
Horn W, Kahle I, Friese G, Gaedike R (1990) Collectiones entomologicae. Ein Kompendium u¨ ber den Verbleib entomologischer
Sammlungen der Welt bis 1960. Akad Landw Wiss DDR Teil I: A bis K.
Mallet J (2005) Hybridization as an invasion of the genome. Trends Ecol Evol 20:229–237.
Mutanen M (2005) Delimitation difficulties in species splits: a morphometric case study on Euxoa tritici complex (Lepidoptera,
Noctuidae). Syst Entomol 30:632–643.
Mutanen M, Pretorius E (2007) Subjective visual evaluation vs. traditional and geometric morphometrics in species delimitation: a
comparison of moth genitalia. Syst Entomol 32:371–386.
Nazari V, Sperling FAH (2007) Mitochondrial DNA divergence and phylogeography in western Palaearctic Parnassiinae (Lepidoptera: Papilionidae): how many species are there? Insect Syst Evol 38:121-138.
Porter AH, Wenger R, Geiger H, Scholl A, Shapiro AM (1997) The Pontia daplidice-edusa hybrid zone in northwestern Italy. Evolution 51 : 1561–1573.
Rohlf FJ (2006a) TPSDIG, Version 2.10. Department of Ecology and Evolution, State University of New York at Stony Brook (http://life.bio.sunysb.edu/morph/).
Rohlf FJ (2006b) TPSUTIL, Version 1.38. Department of Ecology and Evolution, State University of New York at Stony Brook (http://life.bio.sunysb.edu/morph/).
Rohlf FJ (2007) TPSRELW, Version 1.45. Department of Ecology and Evolution, State University of New York at Stony Brook(http:
life.bio.sunysb.edu/morph/).
Rubinoff D, Holland BS (2005) Between two extremes: mitochondrial DNA is neither the panacea nor the nemesis of phylogenetic and taxonomic inference. Syst Biol 54:952–961.
Schmitt T (2007) Molecular biogeography of Europe: pleistocene cycles and postglacial trends. Front Zool 4:11.
Schmitt T, Mu¨ ller P (2007) Limited hybridization along a large contact zone between two genetic lineages of the butterfly Erebia medusa (Satyrinae, Lepidoptera) in Central Europe. J Zool Syst Evol Res 45:39–46.
Schmitt T, Giessl A, Seitz A (2003) Did Polyommatus icarus (Lepidoptera: Lycaenidae) have distinct glacial refugia in southern Europe? Evidence from population genetics. Biol J Linn Soc 80:529–538.
Schmitt T, Ro¨ ber S, Seitz A (2005) Is the last glaciation the only relevant event for the present genetic population structure of the Meadow Brown butterfly Maniola jurtina (Lepidoptera: Nymphalidae)? Biol J Linn Soc 85:419–431.
Taberlet P, Fumagalli L, Wust-Saucy AG, Cosson JF (1998) Comparative phylogeography and postglacial colonization routes
in Europe. Mol Ecol 7:453–464.
Tolman T, Lewington R (1997) Butterflies of Britain and Europe, Harper Collins, London.
Verity R (1947) Le Farfalle Diurne D Italia 3. Divisione Papilonida. Famiglie Papilionidae e Pieridae. Marzocco, Firenze.
Il n'y a pas de commentaire sur cette page.
[Afficher commentaires/formulaire]


